FÍSICO-QUÍMICA II
Estruturas utilizadas na construção civil, são produzidas de ferro galvanizado que apresenta-se revestido por uma camada de zinco. Se essa capa galvanizada for riscada, o ferro ficará exposto às condições do meio ambiente e poderá formar o hidróxido ferroso. Nesse caso, o zinco, por ser mais reativo, regenera o ferro, conforme a reação representada abaixo:
Fe(OH)2 + Zn ---> Zn(OH)2 + Fe
Sobre essa reação pode-se afirmar:
O ferro sofre redução, pois perderá elétrons.
O zinco sofre oxidação, pois perderá elétrons.
O ferro sofre oxidação, pois ganhará elétrons.
O zinco sofre redução, pois ganhará elétrons.
O ferro sofre oxidação, pois perderá elétrons.
O gráfico a seguir representa a variação de concentração das espécies A, B e C com o tempo: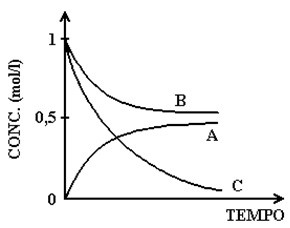
Qual das alternativas a seguir contém a equação química que melhor descreve a reação representada pelo gráfico?
A → 2B + C
2B + C → A
B + C → A
B + 2C → A
2A + B → C
Adiciona-se iodeto de hidrogênio em um recipiente a 458°C. o HI se dissocia formando H2 e I2. Depois de estabelecido o equilíbrio a esta temperatura, são tomadas amostras que são analisadas. O [HI] encontrado é 0,421 mol L-1, quanto [H2] e [I2] são ambos 6,04 x 10-2 mol L-1. Nestas condições, qual o valor da constante de equilíbrio para a dissociação de HI a 458°C?
1,03 x 102
6,04 x 10-2
4,86 x 101
4,21 x 10-2
2,06 x 10-2
É natural pensarmos que ao se atingir o equilíbrio, a reação química para. Entretanto, isso não é verdade, pois no equilíbrio a velocidade de reação inversa é igual à da reação direta, o que faz com que as concentrações de todas as espécies se mantenham constantes. De acordo com a reação N2(g) + 3H2(g) <----> 2NH3(g), se 1,0 mol de N2 e 3,0 mols de H2 forem adicionados em um recipiente de 1,0 litro e depois de estabelecido o equilíbrio, o conteúdo do recipiente analisado foi 0,325 mol L-1 de N2, 0,975 mol L-1 de H2 e 1,350 mol L-1 de NH3, qual será o valor da constante de equilíbrio?
0,17
6,05
5,05
7,58
4,21
O hidrogênio molecular pode ser obtido, industrialmente, pelo tratamento do metano com vapor de água. O processo envolve a seguinte reação endotérmica:
CH4 (g) + H2O (g) = CO (g) + 3 H2 (g)
Com relação ao sistema em equilíbrio, pode-se afirmar, corretamente, que:
A presença de um catalisador afeta a constante de equilíbrio.
O aumento da pressão aumenta a quantidade de CH4 (g).
O aumento da pressão diminui a quantidade de CH4 (g).
O aumento da concentração de H2(g) aumenta a velocidade direta.
A presença de um catalisador afeta a composição da mistura.
Um joalheiro, com pouco conhecimento de eletroquímica, produz uma jóia de prata, com alguns detalhes em níquel. Conhecendo as semi-reações de redução do níquel: Ni2+(aq) + 2 e- = Ni0(s) e da prata: Ag+(aq) + 1 e- = Ag0(s) , assinale a alternativa que apresenta a variação de potencial padrão (ΔE) da pilha, o cátodo e o ânodo são, respectivamente: Dados: E0red Ag = +0,80 V; E0red Ni = -0,24 V.
-1,04 V, níquel, prata.
+1,04 V, prata, níquel.
+0,56 V, prata, níquel.
+1,04 V, níquel, prata.
-0,56 V, prata, níquel.
Uma estrutura galvânica é montada utilizando eletrodos de estanho e de prata, mergulhados em soluções salinas, com as concentrações descritas abaixo. Determine a energia gerada por essa célula:
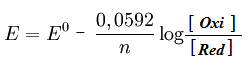
Sn(s)/Sn2+(aq)//Ag+(aq)/Ag(s)
[Sn2+] = 0,077 mol/L
[Ag+] = 0,55 mol/L
EºSn = - 0,14 v
EºAg = + 0,80 v
E = 0,554 V
E = 0,963 V
E = 1,253 V
E = 1,839 V
E = 0,940 V
Imagine uma cela galvânica formada por semi-celas de cobre e de zinco, mergulhados em soluções de sais de Cu2+ e Zn2+, respectivamente, cujos potenciais de redução são os seguintes:
Cu2+ + 2 e – ----> Cu E0 = + 0,34 V
Zn2+ + 2 e – ----> Zn E0 = – 0,76 V
É correto afirmar que:
O potencial padrão da cela é – 0,42 V.
Os elétrons no circuito externo fluirão do eletrodo de cobre para o eletrodo de zinco.
O eletrodo de cobre é o cátodo.
Os íons zinco são reduzidos a zinco metálico.
Quando o equilíbrio for atingido não haverá diferença de potencial entre os eletrodos.
A união de dois metais diferentes gera, automaticamente, uma diferença de potencial (ddp) responsável pela geração de corrente elétrica. Esse processo químico é conhecido, dentro da eletroquímica como "pilha". Em uma pilha de zinco e chumbo, a reação que ocorre é a seguinte:
Pb 2+(aq) + Zn (s) ----> Pb (s) + Zn 2+(aq)
Analisando esse processo, assinale a afirmação correta?
O pólo positivo é o eletrodo de zinco.
Essa reação não ocorreria em solução eletrolítica.
O cátodo é o eletrodo de zinco.
O eletrodo de zinco sofre corrosão.
Os elétrons fluem do eletrodo de chumbo para o eletrodo de zinco.
Assinale abaixo qual alternativa é incorreta acerca de um equilíbrio químico:
A velocidade da reação direta é igual à velocidade da reação inversa.
Os sistemas se deslocam espontaneamente para o estado de equilíbrio.
Obrigatoriamente, as concentrações de todas as substâncias participantes do equilíbrio devem ser iguais.
Ambas as reações (direta e inversa) ocorrem simultaneamente (trata-se de um equilíbrio dinâmico).
As características macroscópicas do sistema (desde que fechado) não mais se alteram.
O ferro sofre redução, pois perderá elétrons.
O zinco sofre oxidação, pois perderá elétrons.
O ferro sofre oxidação, pois ganhará elétrons.
O zinco sofre redução, pois ganhará elétrons.
O ferro sofre oxidação, pois perderá elétrons.
O gráfico a seguir representa a variação de concentração das espécies A, B e C com o tempo:
Qual das alternativas a seguir contém a equação química que melhor descreve a reação representada pelo gráfico?
A → 2B + C
2B + C → A
B + C → A
B + 2C → A
2A + B → C
Adiciona-se iodeto de hidrogênio em um recipiente a 458°C. o HI se dissocia formando H2 e I2. Depois de estabelecido o equilíbrio a esta temperatura, são tomadas amostras que são analisadas. O [HI] encontrado é 0,421 mol L-1, quanto [H2] e [I2] são ambos 6,04 x 10-2 mol L-1. Nestas condições, qual o valor da constante de equilíbrio para a dissociação de HI a 458°C?
1,03 x 102
6,04 x 10-2
4,86 x 101
4,21 x 10-2
2,06 x 10-2
É natural pensarmos que ao se atingir o equilíbrio, a reação química para. Entretanto, isso não é verdade, pois no equilíbrio a velocidade de reação inversa é igual à da reação direta, o que faz com que as concentrações de todas as espécies se mantenham constantes. De acordo com a reação N2(g) + 3H2(g) <----> 2NH3(g), se 1,0 mol de N2 e 3,0 mols de H2 forem adicionados em um recipiente de 1,0 litro e depois de estabelecido o equilíbrio, o conteúdo do recipiente analisado foi 0,325 mol L-1 de N2, 0,975 mol L-1 de H2 e 1,350 mol L-1 de NH3, qual será o valor da constante de equilíbrio?
0,17
6,05
5,05
7,58
4,21
O hidrogênio molecular pode ser obtido, industrialmente, pelo tratamento do metano com vapor de água. O processo envolve a seguinte reação endotérmica:
CH4 (g) + H2O (g) = CO (g) + 3 H2 (g)
Com relação ao sistema em equilíbrio, pode-se afirmar, corretamente, que:
A presença de um catalisador afeta a constante de equilíbrio.
O aumento da pressão aumenta a quantidade de CH4 (g).
O aumento da pressão diminui a quantidade de CH4 (g).
O aumento da concentração de H2(g) aumenta a velocidade direta.
A presença de um catalisador afeta a composição da mistura.
Um joalheiro, com pouco conhecimento de eletroquímica, produz uma jóia de prata, com alguns detalhes em níquel. Conhecendo as semi-reações de redução do níquel: Ni2+(aq) + 2 e- = Ni0(s) e da prata: Ag+(aq) + 1 e- = Ag0(s) , assinale a alternativa que apresenta a variação de potencial padrão (ΔE) da pilha, o cátodo e o ânodo são, respectivamente: Dados: E0red Ag = +0,80 V; E0red Ni = -0,24 V.
-1,04 V, níquel, prata.
+1,04 V, prata, níquel.
+0,56 V, prata, níquel.
+1,04 V, níquel, prata.
-0,56 V, prata, níquel.
Uma estrutura galvânica é montada utilizando eletrodos de estanho e de prata, mergulhados em soluções salinas, com as concentrações descritas abaixo. Determine a energia gerada por essa célula:
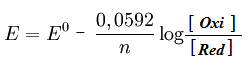
Sn(s)/Sn2+(aq)//Ag+(aq)/Ag(s)
[Sn2+] = 0,077 mol/L
[Ag+] = 0,55 mol/L
EºSn = - 0,14 v
EºAg = + 0,80 v
E = 0,554 V
E = 0,963 V
E = 1,253 V
E = 1,839 V
E = 0,940 V
Imagine uma cela galvânica formada por semi-celas de cobre e de zinco, mergulhados em soluções de sais de Cu2+ e Zn2+, respectivamente, cujos potenciais de redução são os seguintes:
Cu2+ + 2 e – ----> Cu E0 = + 0,34 V
Zn2+ + 2 e – ----> Zn E0 = – 0,76 V
É correto afirmar que:
O potencial padrão da cela é – 0,42 V.
Os elétrons no circuito externo fluirão do eletrodo de cobre para o eletrodo de zinco.
O eletrodo de cobre é o cátodo.
Os íons zinco são reduzidos a zinco metálico.
Quando o equilíbrio for atingido não haverá diferença de potencial entre os eletrodos.
A união de dois metais diferentes gera, automaticamente, uma diferença de potencial (ddp) responsável pela geração de corrente elétrica. Esse processo químico é conhecido, dentro da eletroquímica como "pilha". Em uma pilha de zinco e chumbo, a reação que ocorre é a seguinte:
Pb 2+(aq) + Zn (s) ----> Pb (s) + Zn 2+(aq)
Analisando esse processo, assinale a afirmação correta?
O pólo positivo é o eletrodo de zinco.
Essa reação não ocorreria em solução eletrolítica.
O cátodo é o eletrodo de zinco.
O eletrodo de zinco sofre corrosão.
Os elétrons fluem do eletrodo de chumbo para o eletrodo de zinco.
Assinale abaixo qual alternativa é incorreta acerca de um equilíbrio químico:
A velocidade da reação direta é igual à velocidade da reação inversa.
Os sistemas se deslocam espontaneamente para o estado de equilíbrio.
Obrigatoriamente, as concentrações de todas as substâncias participantes do equilíbrio devem ser iguais.
Ambas as reações (direta e inversa) ocorrem simultaneamente (trata-se de um equilíbrio dinâmico).
As características macroscópicas do sistema (desde que fechado) não mais se alteram.

A → 2B + C
2B + C → A
B + C → A
B + 2C → A
2A + B → C
Adiciona-se iodeto de hidrogênio em um recipiente a 458°C. o HI se dissocia formando H2 e I2. Depois de estabelecido o equilíbrio a esta temperatura, são tomadas amostras que são analisadas. O [HI] encontrado é 0,421 mol L-1, quanto [H2] e [I2] são ambos 6,04 x 10-2 mol L-1. Nestas condições, qual o valor da constante de equilíbrio para a dissociação de HI a 458°C?
1,03 x 102
6,04 x 10-2
4,86 x 101
4,21 x 10-2
2,06 x 10-2
É natural pensarmos que ao se atingir o equilíbrio, a reação química para. Entretanto, isso não é verdade, pois no equilíbrio a velocidade de reação inversa é igual à da reação direta, o que faz com que as concentrações de todas as espécies se mantenham constantes. De acordo com a reação N2(g) + 3H2(g) <----> 2NH3(g), se 1,0 mol de N2 e 3,0 mols de H2 forem adicionados em um recipiente de 1,0 litro e depois de estabelecido o equilíbrio, o conteúdo do recipiente analisado foi 0,325 mol L-1 de N2, 0,975 mol L-1 de H2 e 1,350 mol L-1 de NH3, qual será o valor da constante de equilíbrio?
0,17
6,05
5,05
7,58
4,21
O hidrogênio molecular pode ser obtido, industrialmente, pelo tratamento do metano com vapor de água. O processo envolve a seguinte reação endotérmica:
CH4 (g) + H2O (g) = CO (g) + 3 H2 (g)
Com relação ao sistema em equilíbrio, pode-se afirmar, corretamente, que:
A presença de um catalisador afeta a constante de equilíbrio.
O aumento da pressão aumenta a quantidade de CH4 (g).
O aumento da pressão diminui a quantidade de CH4 (g).
O aumento da concentração de H2(g) aumenta a velocidade direta.
A presença de um catalisador afeta a composição da mistura.
Um joalheiro, com pouco conhecimento de eletroquímica, produz uma jóia de prata, com alguns detalhes em níquel. Conhecendo as semi-reações de redução do níquel: Ni2+(aq) + 2 e- = Ni0(s) e da prata: Ag+(aq) + 1 e- = Ag0(s) , assinale a alternativa que apresenta a variação de potencial padrão (ΔE) da pilha, o cátodo e o ânodo são, respectivamente: Dados: E0red Ag = +0,80 V; E0red Ni = -0,24 V.
-1,04 V, níquel, prata.
+1,04 V, prata, níquel.
+0,56 V, prata, níquel.
+1,04 V, níquel, prata.
-0,56 V, prata, níquel.
Uma estrutura galvânica é montada utilizando eletrodos de estanho e de prata, mergulhados em soluções salinas, com as concentrações descritas abaixo. Determine a energia gerada por essa célula:
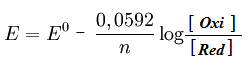
Sn(s)/Sn2+(aq)//Ag+(aq)/Ag(s)
[Sn2+] = 0,077 mol/L
[Ag+] = 0,55 mol/L
EºSn = - 0,14 v
EºAg = + 0,80 v
E = 0,554 V
E = 0,963 V
E = 1,253 V
E = 1,839 V
E = 0,940 V
Imagine uma cela galvânica formada por semi-celas de cobre e de zinco, mergulhados em soluções de sais de Cu2+ e Zn2+, respectivamente, cujos potenciais de redução são os seguintes:
Cu2+ + 2 e – ----> Cu E0 = + 0,34 V
Zn2+ + 2 e – ----> Zn E0 = – 0,76 V
É correto afirmar que:
O potencial padrão da cela é – 0,42 V.
Os elétrons no circuito externo fluirão do eletrodo de cobre para o eletrodo de zinco.
O eletrodo de cobre é o cátodo.
Os íons zinco são reduzidos a zinco metálico.
Quando o equilíbrio for atingido não haverá diferença de potencial entre os eletrodos.
A união de dois metais diferentes gera, automaticamente, uma diferença de potencial (ddp) responsável pela geração de corrente elétrica. Esse processo químico é conhecido, dentro da eletroquímica como "pilha". Em uma pilha de zinco e chumbo, a reação que ocorre é a seguinte:
Pb 2+(aq) + Zn (s) ----> Pb (s) + Zn 2+(aq)
Analisando esse processo, assinale a afirmação correta?
O pólo positivo é o eletrodo de zinco.
Essa reação não ocorreria em solução eletrolítica.
O cátodo é o eletrodo de zinco.
O eletrodo de zinco sofre corrosão.
Os elétrons fluem do eletrodo de chumbo para o eletrodo de zinco.
Assinale abaixo qual alternativa é incorreta acerca de um equilíbrio químico:
A velocidade da reação direta é igual à velocidade da reação inversa.
Os sistemas se deslocam espontaneamente para o estado de equilíbrio.
Obrigatoriamente, as concentrações de todas as substâncias participantes do equilíbrio devem ser iguais.
Ambas as reações (direta e inversa) ocorrem simultaneamente (trata-se de um equilíbrio dinâmico).
As características macroscópicas do sistema (desde que fechado) não mais se alteram.
1,03 x 102
6,04 x 10-2
4,86 x 101
4,21 x 10-2
2,06 x 10-2
É natural pensarmos que ao se atingir o equilíbrio, a reação química para. Entretanto, isso não é verdade, pois no equilíbrio a velocidade de reação inversa é igual à da reação direta, o que faz com que as concentrações de todas as espécies se mantenham constantes. De acordo com a reação N2(g) + 3H2(g) <----> 2NH3(g), se 1,0 mol de N2 e 3,0 mols de H2 forem adicionados em um recipiente de 1,0 litro e depois de estabelecido o equilíbrio, o conteúdo do recipiente analisado foi 0,325 mol L-1 de N2, 0,975 mol L-1 de H2 e 1,350 mol L-1 de NH3, qual será o valor da constante de equilíbrio?
0,17
6,05
5,05
7,58
4,21
O hidrogênio molecular pode ser obtido, industrialmente, pelo tratamento do metano com vapor de água. O processo envolve a seguinte reação endotérmica:
CH4 (g) + H2O (g) = CO (g) + 3 H2 (g)
Com relação ao sistema em equilíbrio, pode-se afirmar, corretamente, que:
A presença de um catalisador afeta a constante de equilíbrio.
O aumento da pressão aumenta a quantidade de CH4 (g).
O aumento da pressão diminui a quantidade de CH4 (g).
O aumento da concentração de H2(g) aumenta a velocidade direta.
A presença de um catalisador afeta a composição da mistura.
Um joalheiro, com pouco conhecimento de eletroquímica, produz uma jóia de prata, com alguns detalhes em níquel. Conhecendo as semi-reações de redução do níquel: Ni2+(aq) + 2 e- = Ni0(s) e da prata: Ag+(aq) + 1 e- = Ag0(s) , assinale a alternativa que apresenta a variação de potencial padrão (ΔE) da pilha, o cátodo e o ânodo são, respectivamente: Dados: E0red Ag = +0,80 V; E0red Ni = -0,24 V.
-1,04 V, níquel, prata.
+1,04 V, prata, níquel.
+0,56 V, prata, níquel.
+1,04 V, níquel, prata.
-0,56 V, prata, níquel.
Uma estrutura galvânica é montada utilizando eletrodos de estanho e de prata, mergulhados em soluções salinas, com as concentrações descritas abaixo. Determine a energia gerada por essa célula:
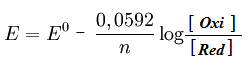
Sn(s)/Sn2+(aq)//Ag+(aq)/Ag(s)
[Sn2+] = 0,077 mol/L
[Ag+] = 0,55 mol/L
EºSn = - 0,14 v
EºAg = + 0,80 v
E = 0,554 V
E = 0,963 V
E = 1,253 V
E = 1,839 V
E = 0,940 V
Imagine uma cela galvânica formada por semi-celas de cobre e de zinco, mergulhados em soluções de sais de Cu2+ e Zn2+, respectivamente, cujos potenciais de redução são os seguintes:
Cu2+ + 2 e – ----> Cu E0 = + 0,34 V
Zn2+ + 2 e – ----> Zn E0 = – 0,76 V
É correto afirmar que:
O potencial padrão da cela é – 0,42 V.
Os elétrons no circuito externo fluirão do eletrodo de cobre para o eletrodo de zinco.
O eletrodo de cobre é o cátodo.
Os íons zinco são reduzidos a zinco metálico.
Quando o equilíbrio for atingido não haverá diferença de potencial entre os eletrodos.
A união de dois metais diferentes gera, automaticamente, uma diferença de potencial (ddp) responsável pela geração de corrente elétrica. Esse processo químico é conhecido, dentro da eletroquímica como "pilha". Em uma pilha de zinco e chumbo, a reação que ocorre é a seguinte:
Pb 2+(aq) + Zn (s) ----> Pb (s) + Zn 2+(aq)
Analisando esse processo, assinale a afirmação correta?
O pólo positivo é o eletrodo de zinco.
Essa reação não ocorreria em solução eletrolítica.
O cátodo é o eletrodo de zinco.
O eletrodo de zinco sofre corrosão.
Os elétrons fluem do eletrodo de chumbo para o eletrodo de zinco.
Assinale abaixo qual alternativa é incorreta acerca de um equilíbrio químico:
A velocidade da reação direta é igual à velocidade da reação inversa.
Os sistemas se deslocam espontaneamente para o estado de equilíbrio.
Obrigatoriamente, as concentrações de todas as substâncias participantes do equilíbrio devem ser iguais.
Ambas as reações (direta e inversa) ocorrem simultaneamente (trata-se de um equilíbrio dinâmico).
As características macroscópicas do sistema (desde que fechado) não mais se alteram.
0,17
6,05
5,05
7,58
4,21
O hidrogênio molecular pode ser obtido, industrialmente, pelo tratamento do metano com vapor de água. O processo envolve a seguinte reação endotérmica:
CH4 (g) + H2O (g) = CO (g) + 3 H2 (g)
Com relação ao sistema em equilíbrio, pode-se afirmar, corretamente, que:
A presença de um catalisador afeta a constante de equilíbrio.
O aumento da pressão aumenta a quantidade de CH4 (g).
O aumento da pressão diminui a quantidade de CH4 (g).
O aumento da concentração de H2(g) aumenta a velocidade direta.
A presença de um catalisador afeta a composição da mistura.
Um joalheiro, com pouco conhecimento de eletroquímica, produz uma jóia de prata, com alguns detalhes em níquel. Conhecendo as semi-reações de redução do níquel: Ni2+(aq) + 2 e- = Ni0(s) e da prata: Ag+(aq) + 1 e- = Ag0(s) , assinale a alternativa que apresenta a variação de potencial padrão (ΔE) da pilha, o cátodo e o ânodo são, respectivamente: Dados: E0red Ag = +0,80 V; E0red Ni = -0,24 V.
-1,04 V, níquel, prata.
+1,04 V, prata, níquel.
+0,56 V, prata, níquel.
+1,04 V, níquel, prata.
-0,56 V, prata, níquel.
Uma estrutura galvânica é montada utilizando eletrodos de estanho e de prata, mergulhados em soluções salinas, com as concentrações descritas abaixo. Determine a energia gerada por essa célula:
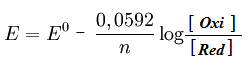
Sn(s)/Sn2+(aq)//Ag+(aq)/Ag(s)
[Sn2+] = 0,077 mol/L
[Ag+] = 0,55 mol/L
EºSn = - 0,14 v
EºAg = + 0,80 v
E = 0,554 V
E = 0,963 V
E = 1,253 V
E = 1,839 V
E = 0,940 V
Imagine uma cela galvânica formada por semi-celas de cobre e de zinco, mergulhados em soluções de sais de Cu2+ e Zn2+, respectivamente, cujos potenciais de redução são os seguintes:
Cu2+ + 2 e – ----> Cu E0 = + 0,34 V
Zn2+ + 2 e – ----> Zn E0 = – 0,76 V
É correto afirmar que:
O potencial padrão da cela é – 0,42 V.
Os elétrons no circuito externo fluirão do eletrodo de cobre para o eletrodo de zinco.
O eletrodo de cobre é o cátodo.
Os íons zinco são reduzidos a zinco metálico.
Quando o equilíbrio for atingido não haverá diferença de potencial entre os eletrodos.
A união de dois metais diferentes gera, automaticamente, uma diferença de potencial (ddp) responsável pela geração de corrente elétrica. Esse processo químico é conhecido, dentro da eletroquímica como "pilha". Em uma pilha de zinco e chumbo, a reação que ocorre é a seguinte:
Pb 2+(aq) + Zn (s) ----> Pb (s) + Zn 2+(aq)
Analisando esse processo, assinale a afirmação correta?
O pólo positivo é o eletrodo de zinco.
Essa reação não ocorreria em solução eletrolítica.
O cátodo é o eletrodo de zinco.
O eletrodo de zinco sofre corrosão.
Os elétrons fluem do eletrodo de chumbo para o eletrodo de zinco.
Assinale abaixo qual alternativa é incorreta acerca de um equilíbrio químico:
A velocidade da reação direta é igual à velocidade da reação inversa.
Os sistemas se deslocam espontaneamente para o estado de equilíbrio.
Obrigatoriamente, as concentrações de todas as substâncias participantes do equilíbrio devem ser iguais.
Ambas as reações (direta e inversa) ocorrem simultaneamente (trata-se de um equilíbrio dinâmico).
As características macroscópicas do sistema (desde que fechado) não mais se alteram.
A presença de um catalisador afeta a constante de equilíbrio.
O aumento da pressão aumenta a quantidade de CH4 (g).
O aumento da pressão diminui a quantidade de CH4 (g).
O aumento da concentração de H2(g) aumenta a velocidade direta.
A presença de um catalisador afeta a composição da mistura.
Um joalheiro, com pouco conhecimento de eletroquímica, produz uma jóia de prata, com alguns detalhes em níquel. Conhecendo as semi-reações de redução do níquel: Ni2+(aq) + 2 e- = Ni0(s) e da prata: Ag+(aq) + 1 e- = Ag0(s) , assinale a alternativa que apresenta a variação de potencial padrão (ΔE) da pilha, o cátodo e o ânodo são, respectivamente: Dados: E0red Ag = +0,80 V; E0red Ni = -0,24 V.
-1,04 V, níquel, prata.
+1,04 V, prata, níquel.
+0,56 V, prata, níquel.
+1,04 V, níquel, prata.
-0,56 V, prata, níquel.
Uma estrutura galvânica é montada utilizando eletrodos de estanho e de prata, mergulhados em soluções salinas, com as concentrações descritas abaixo. Determine a energia gerada por essa célula:
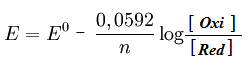
Sn(s)/Sn2+(aq)//Ag+(aq)/Ag(s)
[Sn2+] = 0,077 mol/L
[Ag+] = 0,55 mol/L
EºSn = - 0,14 v
EºAg = + 0,80 v
E = 0,554 V
E = 0,963 V
E = 1,253 V
E = 1,839 V
E = 0,940 V
Imagine uma cela galvânica formada por semi-celas de cobre e de zinco, mergulhados em soluções de sais de Cu2+ e Zn2+, respectivamente, cujos potenciais de redução são os seguintes:
Cu2+ + 2 e – ----> Cu E0 = + 0,34 V
Zn2+ + 2 e – ----> Zn E0 = – 0,76 V
É correto afirmar que:
O potencial padrão da cela é – 0,42 V.
Os elétrons no circuito externo fluirão do eletrodo de cobre para o eletrodo de zinco.
O eletrodo de cobre é o cátodo.
Os íons zinco são reduzidos a zinco metálico.
Quando o equilíbrio for atingido não haverá diferença de potencial entre os eletrodos.
A união de dois metais diferentes gera, automaticamente, uma diferença de potencial (ddp) responsável pela geração de corrente elétrica. Esse processo químico é conhecido, dentro da eletroquímica como "pilha". Em uma pilha de zinco e chumbo, a reação que ocorre é a seguinte:
Pb 2+(aq) + Zn (s) ----> Pb (s) + Zn 2+(aq)
Analisando esse processo, assinale a afirmação correta?
O pólo positivo é o eletrodo de zinco.
Essa reação não ocorreria em solução eletrolítica.
O cátodo é o eletrodo de zinco.
O eletrodo de zinco sofre corrosão.
Os elétrons fluem do eletrodo de chumbo para o eletrodo de zinco.
Assinale abaixo qual alternativa é incorreta acerca de um equilíbrio químico:
A velocidade da reação direta é igual à velocidade da reação inversa.
Os sistemas se deslocam espontaneamente para o estado de equilíbrio.
Obrigatoriamente, as concentrações de todas as substâncias participantes do equilíbrio devem ser iguais.
Ambas as reações (direta e inversa) ocorrem simultaneamente (trata-se de um equilíbrio dinâmico).
As características macroscópicas do sistema (desde que fechado) não mais se alteram.
-1,04 V, níquel, prata.
+1,04 V, prata, níquel.
+0,56 V, prata, níquel.
+1,04 V, níquel, prata.
-0,56 V, prata, níquel.
Uma estrutura galvânica é montada utilizando eletrodos de estanho e de prata, mergulhados em soluções salinas, com as concentrações descritas abaixo. Determine a energia gerada por essa célula:
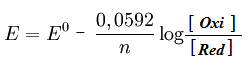
Sn(s)/Sn2+(aq)//Ag+(aq)/Ag(s)
[Sn2+] = 0,077 mol/L
[Ag+] = 0,55 mol/L
EºSn = - 0,14 v
EºAg = + 0,80 v
E = 0,554 V
E = 0,963 V
E = 1,253 V
E = 1,839 V
E = 0,940 V
Imagine uma cela galvânica formada por semi-celas de cobre e de zinco, mergulhados em soluções de sais de Cu2+ e Zn2+, respectivamente, cujos potenciais de redução são os seguintes:
Cu2+ + 2 e – ----> Cu E0 = + 0,34 V
Zn2+ + 2 e – ----> Zn E0 = – 0,76 V
É correto afirmar que:
O potencial padrão da cela é – 0,42 V.
Os elétrons no circuito externo fluirão do eletrodo de cobre para o eletrodo de zinco.
O eletrodo de cobre é o cátodo.
Os íons zinco são reduzidos a zinco metálico.
Quando o equilíbrio for atingido não haverá diferença de potencial entre os eletrodos.
A união de dois metais diferentes gera, automaticamente, uma diferença de potencial (ddp) responsável pela geração de corrente elétrica. Esse processo químico é conhecido, dentro da eletroquímica como "pilha". Em uma pilha de zinco e chumbo, a reação que ocorre é a seguinte:
Pb 2+(aq) + Zn (s) ----> Pb (s) + Zn 2+(aq)
Analisando esse processo, assinale a afirmação correta?
O pólo positivo é o eletrodo de zinco.
Essa reação não ocorreria em solução eletrolítica.
O cátodo é o eletrodo de zinco.
O eletrodo de zinco sofre corrosão.
Os elétrons fluem do eletrodo de chumbo para o eletrodo de zinco.
Assinale abaixo qual alternativa é incorreta acerca de um equilíbrio químico:
A velocidade da reação direta é igual à velocidade da reação inversa.
Os sistemas se deslocam espontaneamente para o estado de equilíbrio.
Obrigatoriamente, as concentrações de todas as substâncias participantes do equilíbrio devem ser iguais.
Ambas as reações (direta e inversa) ocorrem simultaneamente (trata-se de um equilíbrio dinâmico).
As características macroscópicas do sistema (desde que fechado) não mais se alteram.
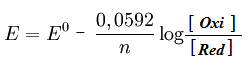
E = 0,554 V
E = 0,963 V
E = 1,253 V
E = 1,839 V
E = 0,940 V
Imagine uma cela galvânica formada por semi-celas de cobre e de zinco, mergulhados em soluções de sais de Cu2+ e Zn2+, respectivamente, cujos potenciais de redução são os seguintes:
Cu2+ + 2 e – ----> Cu E0 = + 0,34 V
Zn2+ + 2 e – ----> Zn E0 = – 0,76 V
É correto afirmar que:
O potencial padrão da cela é – 0,42 V.
Os elétrons no circuito externo fluirão do eletrodo de cobre para o eletrodo de zinco.
O eletrodo de cobre é o cátodo.
Os íons zinco são reduzidos a zinco metálico.
Quando o equilíbrio for atingido não haverá diferença de potencial entre os eletrodos.
A união de dois metais diferentes gera, automaticamente, uma diferença de potencial (ddp) responsável pela geração de corrente elétrica. Esse processo químico é conhecido, dentro da eletroquímica como "pilha". Em uma pilha de zinco e chumbo, a reação que ocorre é a seguinte:
Pb 2+(aq) + Zn (s) ----> Pb (s) + Zn 2+(aq)
Analisando esse processo, assinale a afirmação correta?
O pólo positivo é o eletrodo de zinco.
Essa reação não ocorreria em solução eletrolítica.
O cátodo é o eletrodo de zinco.
O eletrodo de zinco sofre corrosão.
Os elétrons fluem do eletrodo de chumbo para o eletrodo de zinco.
Assinale abaixo qual alternativa é incorreta acerca de um equilíbrio químico:
A velocidade da reação direta é igual à velocidade da reação inversa.
Os sistemas se deslocam espontaneamente para o estado de equilíbrio.
Obrigatoriamente, as concentrações de todas as substâncias participantes do equilíbrio devem ser iguais.
Ambas as reações (direta e inversa) ocorrem simultaneamente (trata-se de um equilíbrio dinâmico).
As características macroscópicas do sistema (desde que fechado) não mais se alteram.
Zn2+ + 2 e – ----> Zn E0 = – 0,76 V
O potencial padrão da cela é – 0,42 V.
Os elétrons no circuito externo fluirão do eletrodo de cobre para o eletrodo de zinco.
O eletrodo de cobre é o cátodo.
Os íons zinco são reduzidos a zinco metálico.
Quando o equilíbrio for atingido não haverá diferença de potencial entre os eletrodos.
A união de dois metais diferentes gera, automaticamente, uma diferença de potencial (ddp) responsável pela geração de corrente elétrica. Esse processo químico é conhecido, dentro da eletroquímica como "pilha". Em uma pilha de zinco e chumbo, a reação que ocorre é a seguinte:
Pb 2+(aq) + Zn (s) ----> Pb (s) + Zn 2+(aq)
Analisando esse processo, assinale a afirmação correta?
O pólo positivo é o eletrodo de zinco.
Essa reação não ocorreria em solução eletrolítica.
O cátodo é o eletrodo de zinco.
O eletrodo de zinco sofre corrosão.
Os elétrons fluem do eletrodo de chumbo para o eletrodo de zinco.
Assinale abaixo qual alternativa é incorreta acerca de um equilíbrio químico:
A velocidade da reação direta é igual à velocidade da reação inversa.
Os sistemas se deslocam espontaneamente para o estado de equilíbrio.
Obrigatoriamente, as concentrações de todas as substâncias participantes do equilíbrio devem ser iguais.
Ambas as reações (direta e inversa) ocorrem simultaneamente (trata-se de um equilíbrio dinâmico).
As características macroscópicas do sistema (desde que fechado) não mais se alteram.
O pólo positivo é o eletrodo de zinco.
Essa reação não ocorreria em solução eletrolítica.
O cátodo é o eletrodo de zinco.
O eletrodo de zinco sofre corrosão.
Os elétrons fluem do eletrodo de chumbo para o eletrodo de zinco.
Assinale abaixo qual alternativa é incorreta acerca de um equilíbrio químico:
A velocidade da reação direta é igual à velocidade da reação inversa.
Os sistemas se deslocam espontaneamente para o estado de equilíbrio.
Obrigatoriamente, as concentrações de todas as substâncias participantes do equilíbrio devem ser iguais.
Ambas as reações (direta e inversa) ocorrem simultaneamente (trata-se de um equilíbrio dinâmico).
As características macroscópicas do sistema (desde que fechado) não mais se alteram.
A velocidade da reação direta é igual à velocidade da reação inversa.
Os sistemas se deslocam espontaneamente para o estado de equilíbrio.
Obrigatoriamente, as concentrações de todas as substâncias participantes do equilíbrio devem ser iguais.
Ambas as reações (direta e inversa) ocorrem simultaneamente (trata-se de um equilíbrio dinâmico).
As características macroscópicas do sistema (desde que fechado) não mais se alteram.